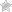Cuando algo no se hace bien desde el principio rara vez tiende a mejorar con el paso del tiempo. Todo lo contrario. Su tendencia es a enmarañarse más y más para acabar resultando un claro perjuicio. El borrador para la regulación de productos homeopáticos aprobado este 24 de abril en el Consejo Interterritorial del Sistema Nacional de Salud y publicado finalmente como Orden Ministerial en el BOE el 28 de abril en España sigue ese camino
Antes de entrar en la evaluación de la Orden Ministerial, recordamos lo que han sido los últimos casi 35 años (que se dice pronto) de este despropósito recapitulamos lo más importante (y que ya tratamos con amplitud en los artículos «Un país y la homeopatía» y «Disposición transitoria sexta»):
– La Ley del Medicamento española de 1990, en su artículo 54, establecía que los productos homeopáticos debían seguir el mismo régimen que todos los medicamentos. Por tanto, para su registro debían pasar los controles, acreditación de efecto terapéutico alegado, constatación y declaración de efectos secundarios, etc. de estos. La realidad es que los productos estaban en el mercado «por libre» y sin registro ni autorización.
– Esta Ley 25/1990 tuvo que adaptarse a las directrices de la directiva europea 92/73/CEE. Entre los puntos a modificar estaba la regulación de los productos homeopáticos y los requisitos para la autorización de su venta.
– La adaptación de ellos se realizó en el Real Decreto 2208/1994 «por el que se regula los medicamentos homeopáticos de uso humano de fabricación industrial». Recogía la obligatoriedad del registro de los productos para su puesta en el mercado, ya fuese con mención terapéutica (debía demostrarla) o sin ella (en cuyo caso debía llevar en su etiquetado la mención “medicamento homeopático «sin indicaciones terapéuticas aprobadas»«). También destaca cuál es la dilución para poder considerarse homeopático («superior a 1/10.000 [2CH o 4DH] y nunca más de la centésima parte de la dosis más baja que eventualmente se emplee en medicina alopática de aquellos principios activos cuya presencia en un medicamento alopático implique la obligatoriedad de presentar receta médica).
– Los productos disponibles en el mercado con anterioridad debían obligatoriamente registrarse según lo indicado en este Real Decreto y para ello se estableció un sistema de solicitud de registro obligatorio por el que, a partir de 29/05/1995 todos los comercializados (por fabricantes previamente autorizados) debían contar con la autorización, mostrar su número de registro y haber pagado las tasas correspondientes (y, obviamente, seguir pagándolas mientras estuviesen en el mercado).
Las 19.134 solicitudes
– Los fabricantes realizaron entonces (según numerosas fuentes) alrededor de 19.000 solicitudes de autorización de los diferentes productos que ya vendían (el diario ABC las concreta estos días en 19.134 sin citar fuente). Sin embargo, ninguna de estas solicitudes se tradujo en autorización gubernativa.
– Tampoco se autorizó ningún otro producto homeopático desde 1995 hasta la llegada de la norma que reemplazó al RD 2208/1994 pese a que sí constan algunas solicitudes (denegadas) de nuevos productos posteriores a esa fecha hasta la entrada en vigor de la norma que lo sucedió.
– Por tanto, entre 1995 y 2007 toda la homeopatía que se vendió carecía de autorización legal para estar presente en el mercado. Tampoco pagó las tasas pertinentes.
– La necesidad de unificar en un solo texto legal la normativa relativa a medicamentos de uso humano propició la derogación del RD 2208/1994 por el Real Decreto 1345/2007, de 11 de octubre, «por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente». Es la norma española vigente de mayor rango acerca de los productos homeopáticos.
– La regulación de los homeopáticos aparece en la Sección 5ª (artículos del 55 al 58) del RD 1345/2007 y apenas modifica lo dicho en el RD 2208/1994 (por ejemplo cambia la mención anterior sobre la ausencia de indicaciones a «Medicamento homeopático sin indicaciones terapéuticas aprobadas»), estableciendo el modo para que nuevos productos se inscribiesen.
Agarrarse a una disposición transitoria ardiente
– Pese a que el RD 2208/1994 no se tradujo en ninguna autorización, el RD 1345/2007 estableció una vía para que las 19.134 solicitudes pudieran adecuarse a la nueva norma. Para ello, en su «Disposición transitoria sexta» abre un periodo para que los fabricantes comuniquen su intención de adecuación. A la solicitud debían acompañar el pago de tasas pertinente.
– Para llevar a cabo todo ello el Ministerio de Sanidad y AEMPS establecerían un procedimiento que aparecería en una Orden ministerial. Han tenido que pasar más de 10 años para la publicación de dicha Orden.
– Lógicamente, a día de hoy no consta ninguna autorización otorgada a ningún producto homeopático al abrigo de esta Disposición transitoria sexta aunque los fabricantes la hayan usado como «escudo» y así lo exhiben en muchos de sus prospectos.
– Desde la entrada en vigor del RD 1345/2007 hasta el día de hoy, tan solo se han inscrito 12 nuevos productos homeopáticos (todos del mismo fabricante y diluciones diferentes de una misma cepa). De las dichas inscripciones no queda vigente a día de hoy ninguna.
– Por si todavía no queda claro: a fecha 28 de abril de 2018 no se comercializa ni un solo producto homeopático en España que cuente con autorización legal para estar en las farmacias. Sin embargo son muy pocas las farmacias donde no verán estos productos.
– También se están comercializando nuevos productos sin autorización pese a que no tienen cabida en ninguno de los procesos regulatorios. Comenzaron a comercializarse después del establecido en el RD 2208/1994. De hecho, alguno de sus fabricantes que no existía antes de esa fechas.
– Las únicas tasas que se han pagado desde 1994 son las de solicitud de registro de los 19.134 productos (que no de autorización) y las que cada fabricante paga para que su industria conste como autorizada.
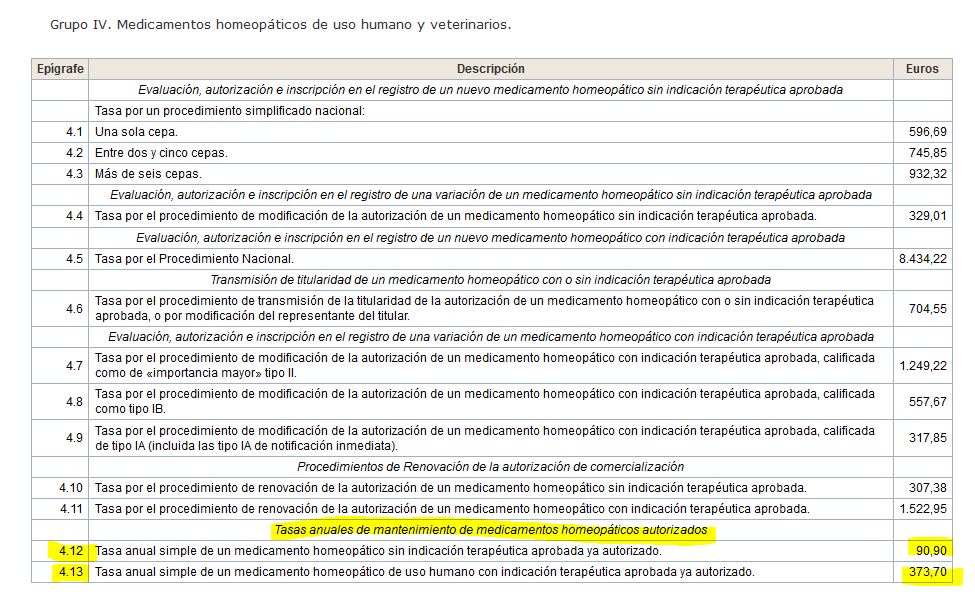
– No se han pagado ni tasas anuales, ni tasas de renovación quinquenal, ni tasas de adecuación al RD 1345/2007. Esto supone varias decenas de millones de euros en total.
2018: el borrador de 2013 sale del cajón
Hace unas semanas tuvimos conocimiento de que el Ministerio de Sanidad comandado por Dolors Montserrat había sacado del cajón el borrador de regulación que Ana Mato había elaborado en 2013 y que por presiones de varios sectores, entre ellos de los propios fabricantes (por motivos que recordaremos más adelante), quedó en el olvido.

Posible aspecto del cajón donde estaba el borrador.
La motivación para desempolvar el borrador no salió del propio Ministerio sino de la Unión Europea. La UE expedientó a España por que la situación regulatoria actual altera la importación de homeopatía desde otros países comunitarios (países donde radican los principales fabricantes que, a buen seguro, han tenido que ver con dicho expediente). Un nuevo despropósito que, de suceder, se pagaría (cómo no) del erario público.
A finales de marzo se comenzó a saber algo sobre el borrador que estaba prácticamente cerrado. El mismo se debatiría en la reunión del Consejo Interterritorial del Sist. Nac. de Sanidad de abril.
Un borrador emborronado para una regulación enmarañada
El medio digital Redacción Médica publicó en primicia el 15 de abril el borrador que se debatiría en el Consejo Interterritorial: https://www.redaccionmedica.com/secciones/sanidad-hoy/el-registro-de-los-productos-homeopaticos-se-elaborara-en-tres-meses-6350
La lectura de dicho documento, fechado el 16/03/2018, arroja muchas dudas y sombras además de la sensación de que vuelve a legislar (no reinterpretar sino «relegislar») algunos puntos de normas anteriores.
Sin embargo, la premura de para su publicación ha hecho que este artículo se centre finalmente en la Orden Ministerial definitiva que, como decíamos al comienzo, ha sido publicada este sábado 28 de abril de 2018. Las diferencias son mínimas y sobre todo centradas en mencionar, precisamente, que pasó el filtro del Consejo Interterritorial.
El primer problema ya en el preámbulo
Afirmaba el borrador en su preámbulo que tras el RD 2208/1994 «pudieron continuar en el mercado aquellos medicamentos homeopáticos que hubiesen presentado la solicitud de autorización y registro correspondiente dentro de los seis meses siguientes a su entrada en vigor» lo cual es falso ya que, como dice dicho Real Decreto en su Disposición primera, además de la solicitud era requisito la concesión de autorización desde la parte gubernativa. El silencio administrativo no otorgaba autorización (lógico al ser necesario número de autorización, control por parte de la agencia pertinente, etc.). Esto no se ha corregido y forma parte de la Orden publicada.
Huelga, por tanto, la frase sobre que la Orden «permitirá poner fin a la situación de transitoriedad en la que se encuentran los medicamentos homeopáticos referidos anteriormente» ya que crea una situación de transitoriedad que jamás ha existido legalmente como demuestra el hecho de que los fabricantes no han pagado las tasas anuales ni de renovación cada cinco años de cada producto de los 19.134 solicitados en 1995.
El articulado de la Orden
– El Artículo 1 recuerda que la Orden se centra exclusivamente en el procedimiento de registro para aquellos de los 19.134 productos que solicitaron su regulación por el RD 2208/1994, tal como indicaba hace más de 10 años el RD 1345/2007 en su Disposición Transitoria Sexta. Insistimos, no se refiere a los productos nuevos posteriores a mayo de 1995, que sí tenían su forma de registro regulada.
– El segundo establece el plazo de comunicación (tres meses desde la entrada en vigor de la Orden, en este caso desde el día siguiente a su publicación o sea, el 29/04/2018), que esta será en soporte informático y que deberá ir acompañada de acreditación del pago de la tasa que recoge el Real Decreto Legislativo 1/2015. Esta tasa no es una de inscripción o de renovación de autorización, ¡sino la de renovación anual! Es decir, los productos homeopáticos llevan décadas sin pagar las tasas a las que les obliga la ley… y los premian regulándolos con una tasa ínfima. Escandaloso.
– Establece un plazo de subsanación en caso de errores y deja claro que de no realizarse esta se entenderá desistida la solicitud.
– En el punto 3 de este Artículo 2 se establece que el regulador responderá con un listado de los productos solicitantes tres meses después de cumplirse el plazo para comunicaciones (en este caso el 29/07/2018), estableciendo un calendario para que los comunicantes soliciten la autorización de comercialización (que es distinta de la autorización de registro) tal como indica la Sección 5ª del RD 1345/2007 dedicada a este tipo de productos.
– En el punto 4, el Ministerio se cubre las espaldas por si no es capaz de procesar todas las comunicaciones recibidas durante tres meses más los tres meses que se deja en exclusiva para ello. Es decir, podría suceder que no publique un listado de solicitudes. En ese caso de «silencio» permitirá a los solicitantes (entendemos que siempre que tengan acreditada dicha solicitud) realizar la petición de autorización para la comercialización.
– El artículo 3 establece qué debe contener la comunicación, como por ejemplo si se solicitará que tenga indicación terapéutica o no, composición cuantitativa y cualitativa, etc. Si solicita alegar acción terapéutica tendrá demostrarla lo cual, teniendo en cuenta la total carencia de pruebas que avalen la homeopatía y unido al mayor coste de las tasas de este tipo de indicación, hará que NADIE use esta vía por lo que es fácil deducir que TODOS los productos en el mercado deberán llevar en su etiquetado el texto «Medicamento homeopático sin indicaciones terapéuticas aprobadas».

¿A qué legalidad se ajusta este prospecto?
¿Más amnistía?
– El punto 2 de este artículo 3 es, sin duda, otro de los más dudosos de esta orden: «Los titulares de los medicamentos homeopáticos podrán incluir en una única comunicación todas las diluciones de un mismo medicamento homeopático». Podría dar a entender que, más allá de simplificar el procedimiento para ambas partes, se va a considerar como un único producto las diferentes diluciones de una misma cepa.
– Si esto fuese así quizás AEMPS requeriría tan solo (y tal como demandaban los fabricantes, siendo este uno de los motivos del retraso de la Orden) el registro y autorización de un producto pese a tratarse de varios (así los consideran los propios homeópatas que por eso usan diferentes diluciones según la dolencia). Sin embargo, al hablar del etiquetado el RD 1345/2007 (artículo 58, punto 2a) sí especifica que se indicará la dilución de la cepa homeopática.
– Esto da a entender claramente que el RD 1345/2007 sí considera productos diferentes las diferentes diluciones y, como tal, deben registrarse no siendo compatible con la idea que sugiere la Orden. A priori no nos atrevemos a afirmar categóricamente qué sucederá aunque, en vista de la permisividad, nos tememos que sucederá esa tremenda «simplificación» de los costes de registro para los fabricantes.
– El Artículo 4 describe los efectos de la no presentación de la comunicación que, obviamente, consisten en la no posibilidad de comercialización y la retirada del mercado.
Que la maraña no nos impida ver el bosque
Es evidente que el organismo legislativo va a realizar una amnistía desde varios frentes a los fabricantes de homeopatía:
– Regulación de productos que llevan décadas en el mercado sin autorización pese a no estar legalmente recogidos por el RD 2208/1994.
– Olvido definitivo de las tasas obligatorias no abonadas desde 1995.
– Regulación/registro a precio de mantenimiento anual de la autorización.
– Posible agrupamiento de los productos que antes (tal y como hizo DHU con sus 12 autorizados) habían sido autorizados uno a uno y no por «cepa». Un ejemplo muy gráfico podría ser el del propio Lycopodium de Dhu. En lugar de ser 12 productos se autorizaría como uno solo con diferentes diluciones con la consiguiente reducción 1/12 de las tasas, no solo la de registro sino las futuras de renovación anual, la quinquenal, etc.
– Tampoco se dice qué deben hacer los productos en el mercado en estos momentos que, como mínimo, van a disfrutar de otros 3 meses de injustificada amnistía.
– Tampoco establece protocolos de revisión de productos en el mercado, lo cual es más que razonable sabiendo que muchos están sin posibilidad de acogerse a esta Orden y que también habrá quien no retire alguno de los que no solicite… total, una vez en el mercado.

Por mucho lío que parezca haber la homeopatía sigue sin funcionar.
Cabría la tentación de pensar en que el pago de las tasas pendientes desde 1995 ha prescrito pero no podemos considerarlo así para los 19.134 productos que buscaron adecuarse a la legalidad en el RD 2208/1994 precisamente por la «transitoriedad» que afirma la Orden. Si esta de verdad ha existido (que no) sin duda los productos deberían haber pagado aquello que les correspondía. En el otro extremo, como indica nuestro análisis, dicha «transitoriedad» nunca ha existido por lo cual no ha lugar a una regulación de algo que no se comprende en lo regulado.
Y, desde luego, no hay excusa para los nuevos productos que se incorporaron al mercado después de 1995, que de ninguna manera se pueden acoger a la posible Orden al no estar dentro de los RD 2208/1994 ni 1345/2007 y que sí tenían un procedimiento descrito para su inscripción y autorización.
Por fin, voces desde lo alto contrarias al engaño homeopático
Durante la consulta autonómica se sucedieron las opiniones de diversos sectores, contrarios tanto a la regulación (que permite refrendar la denominación «medicamento homeopático» que estos productos llevan años utilizando) como la condonación de una deuda multimillonaria.
Algunas pudieron hablar (aunque se les hizo caso omiso) en el Consejo Interterritorial, tal como recoge la propia Orden («durante el procedimiento de elaboración de la norma, se ha consultado a las comunidades autónomas y sectores afectados»). Tras la consulta, queda claro que se hizo caso a los «sectores afectados».
- Los colegios oficiales de medicina, odontología, veterinaria y farmacia de Gipuzkoa han dicho que «en el actual estado de conocimiento científico no existen argumentos que apoyen la eficacia de los medicamentos y productos homeopáticos que justifiquen su utilización clínica».
- El Consejero de Sanidad de Galicia, Jesús Vázquez Almuiña, afirmó tras el Consejo Interterritorial (donde presentó una propuesta que rechazaba la denominación de «medicamento» para estos productos que «nosotros lo tenemos muy claro, no es válida y no creemos en la seudociencia».
- La Organización Médica Colegial, por medio de Jerónimo Fernández, solicitó la retirada de estos productos de las farmacias.
- El Consejero de Sanidad de Extremadura, José María Vergelez, declaró «Clasificar un medicamento como medicamento requiere una serie de procedimientos, realizar ensayos clínicos… mientras no los tenga, no se puede considerar medicamento homeopático ni de ninguna clase».
- Una de las voces más claras desde que ocupó el cargo es la de la Consejera de Sanidad de la Comunidad Valenciana, Carmen Montón, que dijo sobre estos productos que “es una sustancia que no cura” y que “puede poner en riesgo la salud”.
- La Consejera andaluza, Marina Álvarez, tampoco escatimó calificativos para esta pseudociencia: «Nuestra comunidad no está de acuerdo con este posicionamiento porque pensamos que puede llevar a confusión o a incrementar que se crea realmente que esos productos están avalados por el Ministerio».
https://twitter.com/IUCiencia/status/989114080127541248
Lamentablemente, algunas comunidades autónomas como la Región de Murcia («posicionarse políticamente sin el respaldo técnico adecuado es arriesgado y en cualquier caso demagógico y oportunista») prefirieron seguir la doctrina marcada por el Ministerio de Sanidad y no mostrar rechazo a esta pseudoterapia, lo cual se comprende al compartir partido político con el ministerial.
[Actualización 29/04/2018] El programa de RNE «No es un día cualquiera» ha entrevistado, dentro de la sección de Boticaria García (desde 14’10»), y al respecto de la regulación, al subdirector de la Agencia Española del Medicamentos y Productos Sanitarios (AEMPS), César Hernández (a partir de 26’12»).
Entre las afirmaciones realizadas por el señor Hernández está que «los únicos medicamentos homeopáticos que han estado autorizados han estado autorizados con prescripción médica», algo que es falso de toda falsedad. No es necesaria ninguna receta para comprar cualquiera de los productos homeopáticos que a día de hoy, de forma irregular, están en el mercado. Ni es necesario que los indique un médico. De hecho basta con tan solo darse de alta en un epígrafe del Impuesto de Actividades Económicas (1. 944, Servicios de Naturopatía, Acupuntura, Parasanitarios) para trabajar de forma legal (y aunque se carezca de profesión y/o formación sanitaria), de homeópata.
Y para muestra, un botón: el prospecto de uno de los Lycopodium de Dhu, los únicos productos homeopáticos autorizados por AEMPS desde 1994. Les reto a que encuentren el «Medicamento sujeto a prescripción médica» que llevan medicamentos de verdad como pueda ser un antibiótico.
“Cuando una directiva de la UE está en vigor los estados miembros estamos obligados a cumplirla. Pero la legislación española no es más laxa con los productos homeopáticos que la de otros países, todo lo contrario”. César Hernández, subdirector de la @AEMPSGOB
— No es un Día (RNE) (@NEUDC_RNE) April 29, 2018
Reconoce Hernández que, pese a que los productos se han comercializado sin autorización, no se les va a cobrar ninguna tasa adicional a la mínima que ya hemos comentado para regularizarse, confirmando la amnistía económica a empresas que han gozado de privilegios y beneficios adicionales por su inacción. Su explicación denota una completa ignorancia (como en el caso anterior) de la legislación aplicable. Y resulta una completa laxitud pese a sus afirmaciones de que serán más duros a partir de ahora (¿cómo si la legislación ya es la que es?).
Otra de sus afirmaciones es terrorífica: «Realmente todavía no sabemos nosotros qué pruebas ni qué ensayos clínicos pueden tener realizados este tipo de productos si es que los han hecho». En otras palabras: saben que hay miles de productos en el mercado pero no tienen ni idea de qué contienen. Algo tan sumamente grave que debería de acarrear despidos (antes que dimisiones) inmediatos en AEMPS.
 Aunque, sin duda, la afirmación más grave de todas (en fuerte liza con César Hernández) es la que ha realizado la propia Ministra de Sanidad, Dolors Montserrat, reconociendo el engaño que suponen estos productos. Un sinsentido. Como todo lo que rodea a la patraña de la homeopatía.
Aunque, sin duda, la afirmación más grave de todas (en fuerte liza con César Hernández) es la que ha realizado la propia Ministra de Sanidad, Dolors Montserrat, reconociendo el engaño que suponen estos productos. Un sinsentido. Como todo lo que rodea a la patraña de la homeopatía.
«Decirles bien claro a los pacientes, a las personas que tengan acceso a estos productos homeopáticos que no hay esta evidencia terapéutica y por tanto en la etiqueta pondrá exáctamente «medicamento homeopático sin indicaciones terapéuticas aprobadas»»
Es decir: todos saben que la homeopatía no funciona pero, no solo va a seguir en las farmacias como «medicamento homeopático» (con el riesgo para la salud que eso supone) sino que se va a amnistiar décadas de irregularidad y millones de Euros que no sobran, precisamente, en un sector donde los recortes han sido tónica habitual de los últimos años.
¿Es suficiente el pretexto de que obliga la normativa europea? Lo es para que exista una regulación a corto plazo porque la situación era insostenible, lo cual no es excusa para la amnistía. Pero a medio y largo plazo, si de verdad el Ministerio de Sanidad y las Comunidades Autónomas pretenden luchar contra esta lacra deberán mover el terreno de juego a la Unión Europea. Exponer lo que se ha dicho aquí y promover el cambio de categoría de estos productos. Quizás la más apropiada sea el de «alimentos». Y, desde luego, no les corresponde tampoco la de «complementos nutricionales».
Homeopatía: 0% principio activo. 100% azúcar. pic.twitter.com/8M6EBUHEaa
— SinAzucar.org (@SinAzucarOrg) February 9, 2017
Este es el país que tenemos. O luchamos por cambiarlo (no basta con quejarse) con hechos (y no solo palabras) o todo esto seguirá sucediendo una y otra vez. De momento, habrá que estar muy atentos a que los pasos de esta Orden Ministerial se den con todo el rigor para seguir denunciando todo aquello que, más allá del hecho conocido acerca de la carencia de aval de la homeopatía, se salga además de la regulación vigente, ya sea por acción u omisión cualquiera de las partes. Conociendo los antecedentes, no bastarán mil ojos.
Referencias:
- Nota de prensa de AEMPS acerca de la Orden SSI/425/2018: https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/2018/NI-MUH_1-2018-Homeopaticos.htm
- Orden SSI/425/2018, de 27 de abril, por la que se regula la comunicación que deben realizar los titulares de medicamentos homeopáticos a los que se refiere la disposición transitoria sexta del Real Decreto 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente. (BOE núm. 103, de 28 de abril): http://boe.es/diario_boe/txt.php?id=BOE-A-2018-5803
- Real Decreto 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente.