¿Os imagináis que un diputado proclamase desde su escaño en el Congreso que la soberanía de España reside solo en aquellos que llevan gafas porque lo dice el artículo primero de la Constitución Española? Seguro que no porque es una mentira demasiado obvia. Pues algo así ocurre con el uso que hacen algunas personas de la disposición transitoria sexta del Real Decreto 1345/2007.
En un burdo intento de justificar la comercialización fuera de la regulación vigente y ante lo obvio que resulta que, a día de hoy, tan solo 5 productos homeopáticos tengan autorización para estar en el mercado algunos miembros de la comunidad homeopática hacen su propia versión de este punto concreto de esa regla mientras siguen sin reprobar que se vulnere de forma sistemática buena parte del resto de su encunciado de la norma.

El jarabe Stodal se anuncia como «medicamento homeopático» pese a que por su composición no lo es. Y publicita indicaciones terapéuticas pese a no estar autorizado a ello.
La regulación de los productos homeopáticos en España tiene como máxima protagonista a esta norma jurídica con rango de reglamento que, en conjunto, «regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente». Así lo expliqué con profundidad en el artículo «Un país y la homeopatía» donde también expliqué los plazos que hacían que, a día de hoy, el grueso de la homeopatía en España anduviera por terrenos lejanos a la legislación.
Para este artículo voy a considerar cierta una premisa a la que aluden los miembros del sector homeópata: la existencia de 19.000 productos autorizados al amparo de una disposición del Real Decreto 2208/1994:
@Hondoncity Ya que pregunta, no diga que miento.
Puede buscarla entre los presentados a evaluacion al amparo de la disposición transitoria segunda pic.twitter.com/U3fGzJmp74— Gualberto Diaz Saez (@diazgual) 9 de diciembre de 2016
Disposiciones
Y esto es lo que dice la disposición (en lo sucesivo y para abreviar «DT6») tras la modificación de la que fue fruto en el Real Decreto 686/2013:
Reproduzco también aquí la Disposición transitoria segunda (en lo sucesivo «DT2») del Real Decreto 2208/1994:
En pocas palabras…
- La DT6 se refiere única y exclusivamente a aquellos productos acogidos a la mencionada DT2 del RD 2208/1994 por lo que debían estar ya presentes en el mercado antes del 29/11/1994.
- Supuestamente los fabricantes presentaron tras la publicación del RD 2208/1994 (en el plazo indicado de 6 meses) unos 19.000 productos para acogerlos al DT2.
- Habrían tenido entonces permiso para seguir en el mercado hasta obtener la autorización definitiva, la cual fue denegada por silencio administrativo (gracias a Fernando Frías por el apunte). Para este artículo voy a ignorar esa circunstancia y considerar que mantuvieron ese permiso provisional hasta que el RD 1345/2007 derogó el RD 2208/1994.
- Conocemos con certeza que no hay ninguna autorización definitiva resultante del resto del articulado del RD 2208/1994.
- El apartado 2 del DT6 del RD 1345/2007 dice que los titulares de los 19.000 productos con autorización provisional por el DT2 debían comunicar su intención de adecuarse a la esa nueva norma o ser retirados del mercado.
- Dicha comunicación debía ir acompañada de un pago de tasas por cada producto solicitado. Suponiendo que todos hubiesen optado por el modo simplificado (el que no permite indicaciones terapéuticas) serían unos 400 euros por 19.000. Es decir, supuestamente los fabricantes habrían pagado al menos 7.600.000 Euros en tasas para regularizar su situación.
- La legislación establece que cada producto autorizado debe pagar una tasa anual y otra cada cinco años para renovar su autorización. AEMPS tiene en su web los importes actualizados de cada tasa.
- La legislación no exime a los autorizados por el DT6 de cumplir con las obligaciones que impone a todos los productos homeopáticos en cuando a etiquetado, diluciones mínimas, etc.
- Solo pueden estar en el mercado aquellos productos con autorización de AEMPS.
@LadyPau_ @j_borre @AEMPSGOB » escépticos «desconocen la legislación Disp transitoria 6° autoriza su venta. Son legales aquí y en Europa
— Cesar Valera (@cesarvaleraarna) 7 de diciembre de 2016
Un ejemplo práctico
Para ver en qué se traduce esto de forma práctica veamos el caso del fabricante Boiron. En su listado actual tiene sobre 7.000 referencias de productos homeopáticos sin indicación terapéutica y cerca de 60 con indicación según esa web y las fichas de producto que contiene. De haberlos sometido a la comunicación requerida por el DT6 tendría que haber abonado en ese momento sobre 2.900.000€ en tasas. Sin duda, un hecho relevante a comunicar a sus accionistas.
Curiosamente dicho hecho relevante no aparece en ningún momento en el informe anual de Boiron sobre 2008 (sí se menciona la publicación del RD 1345/2007 en el informe del año anterior). Tampoco aparece en el informe de 2009. Para que os hagáis una idea, esos informes incluyen hasta qué bonus reciben los trabajadores de Boiron España con más de 20 años de servicio.
Los beneficios de la filial española aumentaron de 2007 a 2008 y de 2008 a 2009. Es decir: si en algún momento comunicaron su intención de acogerse al DT6 no pagaron las tasas que debían acompañar dicha comunicación lo cual supondría haber incumplido con lo exigido por el DT6. De hecho, por los informes anuales de Boiron se comprueba que ni siquiera han provisionado esos pagos como reconoce en su informe de 2014.
Todos los productos homeopáticos de Boiron se acogen a la DT6 y según este fabricante eso le autoriza a su venta. Entonces, ¿por qué no pagan entonces la tasa anual por producto ni la de renovación cada cinco años si, como alegan, están autorizados?
Suponiendo que el primer año de pago tras la autorización fuese 2009 estaríamos hablando de 8 pagos de tasa anual y uno de tasa de renovación lo que representaría que Boiron ha dejado de pagar desde la publicación del RD 1345/2007 la nada despreciable cantidad de 11 millones de Euros (aproximadamente) entre solicitud, anualidades y renovación.
No entiendo, por tanto, que sin cumplir con todos los requerimientos del texto de la Disposición transitoria sexta se pueda decir que estos productos son conformes a la misma y carecen de la autorización necesaria para su comercialización.
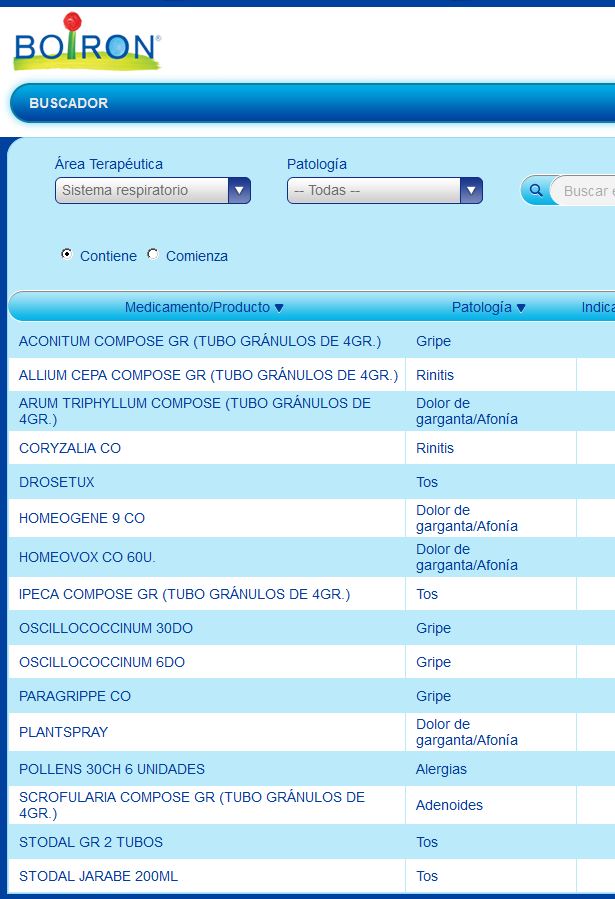
Resultado de buscar productos con indicación para afecciones respiratorias…
No consta que se haya hecho pública ninguna solicitud ni ninguna autorización provisional para ningún producto homeopático. Tampoco hay ninguna circular de AEMPS que pudiera liberar a los fabricantes de los requerimientos de la legislación que, recordemos, exige la retirada del mercado para los productos no autorizados.
Eso no es todo
Acogerse a la DT6 no exime del cumplimiento del resto de obligaciones que establece la legislación sobre productos homeopáticos. Algunos ejemplos de entre los productos que Boiron marca en su «eVademecum» con indicación terapéutica:
- Cicaderma. Esta pomada que Boiron no solo indica para la irritación de la piel sino también para heridas, picaduras, quemaduras, etc. dice ser homeopática cuando lleva para cada 100 gr de producto 20 de calendula officinalis, 10 de hypericum perforatum, 10 de achillea millefolium, 1,5 de tintura madre ledum palustre y 1,5 de tintura de pulsatilla. Los restantes 57 gramos son del excipiente (vaselina). Así se salta a la torera el apartado ‘c’ del artículo 56 del RD 1345/2007, el que garantiza la inocuidad de estos productos por la alta disolución de los principios activos (1/10.000 o una centésima parte de lo que en un medicamento haría que requiriese receta). ¿Solicitó Boiron acoger este producto cuando es obvio que no cumple con la regulación?

- Avenoc. En el caso de este producto no solo se hacen indicaciones no aprobadas (hemorroides) y se superan los mínimos legales de concentración sino que, además, se usa una vía de administración no autorizada (apartado ‘a’ del artículo 56 del RD 1345/2007 para el registro simplificado) ya que la vía para un supositorio no es ni la oral o ni la externa. Su versión «pomada» supera aún más los mínimos de dilución exigidos.

- Endhometrol. De nuevo indicaciones no aprobadas, concentración de tintura de caléndula officinalis por encima de lo autorizado y otra vía de administración no aprobada para la vía simplificada de registro.

- Plantspray. Quizás el caso más llamativo. Este spray que indica Boiron para el dolor de garganta y aftas supera la dilución mínima. Pero lo grave es imposible que se pueda acoger (como indica en su ficha) a la DT6 porque fue lanzado al mercado en el año 2015 lo que hace inviable que se acogiese en su día a la DT2 del 2208/1994. Y deja muy claro que cualquier lanzamiento de nuevo producto homeopático en España desde el 29/11/1994 requiere de una nueva autorización que nunca podría recibir de estas disposiciones.

Con una simple búsqueda en el eVademecum de Boiron encontraréis más casos de indicaciones y productos que superan la concentración mínima marcada por el RD 1345/2007 (en especial los que incluyen en su denominación «compose» o «TM»). Curiosamente se trata de muchos de los productos más vendidos por la multinacional francesa.
Evidentemente estas prácticas no son exclusivas de Boiron y el caso más claro (que no el único) es Traumeel, de Heel, que por su composición tampoco debería llevar «homeopático» en la etiqueta.

Actualización 12/12/2016: Mientras redactaba este artículo envié una consulta a AEMPS sobre lo actualizada que está su base de datos CIMA (Centro de Información online de Medicamentos de la AEMPS). Esta ha sido su respuesta:
La aplicación CIMA está actualizada con un desfase de un máximo de 24 horas con la aplicación de gestión de autorizaciones y comercialización de la AEMPS, por lo que si el código nacional no aparece pasadas 24 horas se debe a un error (del fabricante o nuestro). También debe tener en cuenta que en CIMA solo aparecen los medicamentos autorizados, y aquellos suspendidos o anulados hace menos de 5 años.
Agencia Española de Medicamentos y Productos Sanitarios
División de Sistemas de Información
Conclusión
Si yo fuese fabricante de homeopatía no dudaría en clarificar este tema para dejar la pelota únicamente en el tejado del Ministerio de Sanidad y de AEMPS, haciendo pública la documentación que fuese necesaria. Mis productos llevarían en su etiquetado el número de solicitud de acogimiento a la Disposición transitoria sexta del RD 1345/2007, habría pagado desde el principio las tasas pertinentes y cumpliría escrupulosamente con la norma en cuanto a composición, vías, etiquetado, etc.
Lo que posiblemente subyace es un desacuerdo de los fabricantes de productos homeopáticos con la exigencia del pago de tasas por producto exigido por la regulación que dicen cumplir. Entre los tira y afloja con la AEMPS han ido dilatando algo que les favorece puesto que el producto sigue en la calle, hacen indicaciones sin pasar los requerimientos de este tipo de productos, eluden en muchos casos tener que registrar los productos como el resto de medicamentos (con la inmensa ventaja que supone para ellos), siguen obteniendo más beneficios económicos de los que les corresponde y se va haciendo una «pelota» cada vez más grande con las tasas no pagadas, tanto que cuando un Ministerio de Sanidad diligente trate de normalizar la situación no será capaz de hacerles pagar todo lo que, por ley, deben.
Actualización 21/02/2017: Por si quedaba alguna duda, el director general del fabricante de homeopatía DHU Ibérica confirma en Twitter que en España solo hay cinco productos homeopáticos autorizados de forma legal. Reconoce, por tanto, que comercializa el resto de sus productos de forma alegal. Resultado merecido para su intento de «hombre de paja«.
Los escépticos reconocen la evidencia los #medicamentoshomeopaticos son legales en España , aunque 5 es la prueba definitiva @DolorsMM pic.twitter.com/TfAdduiCTT
— alex castilla (@alex73castilla) 21 de febrero de 2017
Actualización 28/04/2018: Se publica la Orden Ministerial (Orden SSI/425/2018) que indica el procedimiento de regulación de aquellos de los 19.134 productos que solicitaron acogerse al RD 2208/1194. Analizamos en el artículo «Una regulación emborronada con tinta diluída» el escándalo que supone.



